麻省理工學院:雙組分系統可以提供一種阻止內出血的新方法
這項技術模仿身體的自然凝血過程,可以幫助重傷的人活著,直到他們在醫院接受。
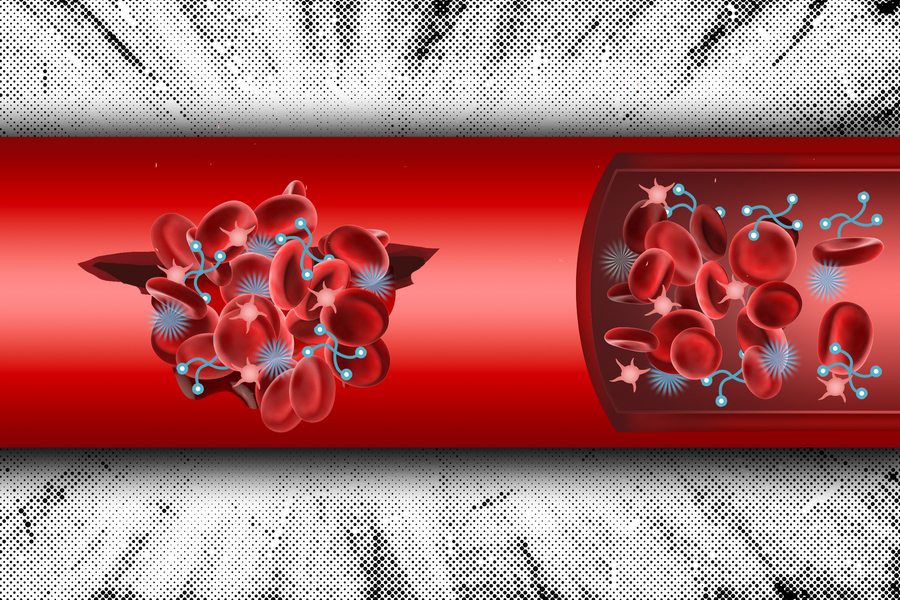
麻省理工學院的工程師設計了一個雙組分系統,可以注射到體內并幫助在內傷部位形成血凝塊。這些材料模仿身體自然形成凝塊的方式,可以提供一種方法,讓嚴重內傷的人活著,直到他們到達醫院。
在小鼠內傷模型中,研究人員表明,這些成分 - 納米顆粒和聚合物 - 比早期開發的止血納米顆粒表現明顯更好。
“這些結果特別引人注目的是我們在動物研究中看到的嚴重傷害的恢復水平。通過依次引入兩個互補系統,可以獲得更強的凝塊,“麻省理工學院教授,麻省理工學院化學工程系主任,科赫綜合癌癥研究所成員Paula Hammond說,也是該研究論文的作者之一。
與以前開發的止血系統不同,新的麻省理工學院技術模仿血小板(啟動血液凝固的細胞)和纖維蛋白原(一種有助于形成凝塊的蛋白質)的作用。
“使用兩種成分的想法允許止血系統的選擇性凝膠化,因為傷口中的濃度增加,模仿自然凝血級聯的終效果,”麻省理工學院化學工程亞歷山大和I. Michael Kasser教授Bradley Olsen說。
麻省理工學院博士后Celestine Hong PhD ' 22是該論文的主要作者,該論文發表在Advanced Healthcare Materials上。該論文的其他作者包括博士后Yanpu He,本科生Porter Bowen和麻省理工學院生物工程系主任Angela Belcher教授。
人工凝血
車禍等創傷性事件造成的失血每年導致全球2多萬人死亡。這種鈍性創傷會導致肝臟等器官內出血,難以檢測和。在這種情況下,盡快止血至關重要,直到患者可以送往醫院接受進一步。奧爾森說,尋找預防內出血的方法可能會對武裝部隊產生特別重大的影響,其中延遲內出血是可預防死亡的原因之一。
當發生內傷時,血小板被吸引到該部位并啟動血液凝固級聯反應,終形成血小板和凝血蛋白(包括纖維蛋白原)的粘性栓塞。然而,如果患者失血過多,他們沒有足夠的血小板或纖維蛋白原來形成凝塊。麻省理工學院的團隊希望創建一個人工系統,通過更換這兩種凝血成分來幫助挽救人們的生命。
“該領域的研究人員過去一直在做的是試圖重新捕獲血小板的效果或重新捕獲纖維蛋白原的功能,”Hong說。“我們在這個項目中試圖做的是捕捉他們彼此互動的方式。
為了實現這一目標,研究人員創建了一個包含兩種材料的系統:一種是募集血小板的納米顆粒,另一種是模仿纖維蛋白原的聚合物。
對于血小板募集顆粒,研究人員使用了類似于他們在 2022 年一項研究中報告的顆粒。這些顆粒由一種稱為PEG-PLGA的生物相容性聚合物制成,該聚合物通過稱為GRGDS的肽進行功能化,使其能夠與活化的血小板結合。由于血小板被吸引到損傷部位,這些顆粒也傾向于在損傷部位積聚。
在 2022 年的研究中,研究人員發現,當這些靶向顆粒處于 140 至 220 納米的尺寸范圍內時,它們會在傷口部位積聚,但不會在肺部等器官中顯著積聚,在那里凝塊形成對患者有風險。
在這篇論文中,研究人員通過添加一個化學基團來修改這些顆粒,該化學基團將與放置在系統中第二個組分上的標簽發生反應,他們稱之為交聯劑。這些由PEG或PEG-PLGA制成的交聯劑與積聚在傷口部位的靶向顆粒結合,形成模仿血栓的團塊。
“這個想法是,隨著這兩種成分在血液中循環,如果有傷口部位,靶向成分將開始在傷口部位積聚并結合交聯劑,”Hong說。“當兩種成分都處于高濃度時,你會得到更多的交聯,它們開始形成膠水并幫助凝血過程。
止血
為了測試該系統,研究人員使用了內傷小鼠模型。他們發現,注射到體內后,雙組分系統在止血方面非常有效,它的作用大約是目標顆粒本身的兩倍。
凝塊的另一個重要優點是它們不會像天然存在的凝塊那樣快速降解。當患者大量失血時,通常會靜脈給予生理鹽水以維持血壓,但這種生理鹽水也會稀釋現有的血小板和纖維蛋白原,導致凝塊變弱,降解更快。然而,研究人員發現,人造凝塊不那么容易受到這種降解的影響。
研究人員還發現,與葡萄糖對照相比,它們的納米顆粒在小鼠中沒有誘導任何顯著的免疫反應。他們現在計劃與馬薩諸塞州總醫院的研究人員合作,在更大的動物模型中測試該系統。
從長遠來看,研究人員還希望探索使用便攜式成像設備在注射的納米顆粒進入體內后可視化的可能性。這可以幫助醫生或緊急醫療響應人員快速確定內出血的部位,目前只能在醫院通過MRI,超聲波或手術進行。
“在確定出血源在哪里可能會有幾個小時的延遲,這需要很多步驟才能出血部位。因此,能夠將該系統與診斷工具相結合是我們感興趣的一個領域,“Hong說。
該研究由美國陸軍研究辦公室和國防部資助。